Durante el tiempo que he estado ejerciendo mi labor en los laboratorios clínicos, uno va descubriendo cuales son las patologías más críticas y complicadas en el proceso salud – enfermedad. Va uno comprendiendo también que hay condiciones clínicas crónicas que son más fáciles de manejar que otras. Pero en definitiva, sin darle menos importancia a patologías como el cáncer, cardiopatías o enfermedades metabólicas; considero que la falla renal es una de las enfermedades más complejas, difícil de manejar y en definitiva con la condición de cronicidad más desalentador y de complicada resolución.

La enfermedad renal es un proceso por el cual los riñones se afectan de forma parcial o total y no pueden cumplir su función, que en términos generales es filtrar la sangre, para eliminar productos de desecho del cuerpo y retener elementos necesarios para el organismo. Además de depurar nuestra sangre, los riñones ayudan a mantener el volumen normal de líquido en el cuerpo, a liberar hormonas para diversos tipos de funciones endocrinas, controlar la presión arterial, regular el metabolismo de la osteogénesis y de la producción de células sanguíneas entre otras funciones. Hay diversos tipos de enfermedades renales, las principales son la enfermedad renal crónica, los cálculos renales, la pielonefritis, la insuficiencia renal aguda, el cáncer de riñón y otras más. Actualmente la OMS la puso en el puesto número 10 de enfermedades mortales del mundo, afectando a más de 1,3 millones de personas a nivel global (1).
En este capítulo hablaremos sobre la insuficiencia renal aguda (IRA). Es el resultado de complicaciones de origen circulatorio o renal, que ponen crean situaciones estrés oxidativo e inflamatorio el microambiente del , consecuencia de interacciones complejas entre la agresión real y la posterior activación de la inflamación y la coagulación (2). Las causas más frecuentes fueron: necrosis tubular aguda, prerrenal y obstructiva en el 10% de los casos. Es un problema grave a nivel mundial y uno de los principales factores de riesgo para contraer este tipo de patología renal es el ingreso a unidades de cuidados intensivos (UCI) (3).
Estudios estiman que la insuficiencia renal aguda afectaba entre el 1 y el 25% de los pacientes de UCI y con una tasa de mortalidad del 15 al 60% (3). En su ingreso a estás instancias hospitalarias el paciente se ve afectado por por una variedad de alteraciones clínicas que incluyen el shock séptico, la intubación, el manejo con medicamentos nefrotóxicos, el control de la volemia y la coexistencia de enfermedades de base (diabetes, hipertensión, cáncer, etc) con las que haya ingresado el paciente al servicio de UCI.
La IRA tiene multiples definiciones, pero bajo un consenso internacional que involucra el sistema RIFLE (Risk of renal dysfunction, Injury to the kidney, Failure or Loss of kidney function, and End-stage kidney disease) y la red internacional AKI (Acute Kidney Injury); se define que un aumento de la creatinina sérica de ≥ 0,3 mg/dl en 48 horas o un aumento de ≥ 1,5 veces con respecto a un valor basal conocido o supuesto o por un disminución del gasto urinario a menos de 0,5 ml/kg/h durante 6 horas (4).
Para la detección de la IRA se aborda la sospecha en base a componentes clínicos del paciente y de laboratorio; se usan pruebas de laboratorio como la creatinina en sangre, que es un indicativo de función renal, pero es corto para la predicción de la insuficiente renal aguda (5). La creatinina no es suficiente para supervisar estos daños; cuando se mide la creatinina estamos midiendo los efectos posteriores al daño, no estamos supervisando de forma activa y preventiva el daño en sí, sólo se altera cuando se alcanza el 50% de daño renal y es inconsistente en términos de los cambios de masa muscular y la hidratación del paciente. En el caso de la medición de volumen urinario, los cambios de las tasas de excreción se evidencian hasta 6 horas después de comenzar los cambios.
Si observamos la situación bajo la lupa, nos encontramos ante un panorama que les está exigiendo a los especialistas del área de nefrología y de cuidados intensivos la meticulosa y rigurosa vigilancia de los pacientes con las escasas herramientas con las que cuentan . Es bastante evidente que se está subestimando la magnitud de esta enfermedad y existe un subregistro de afectaciones renales causadas a pacientes como consecuencia de una estancia hospitalaria con escasos esfuerzos por vigilar y cuidar el riñón de sus pacientes ingresados (6).
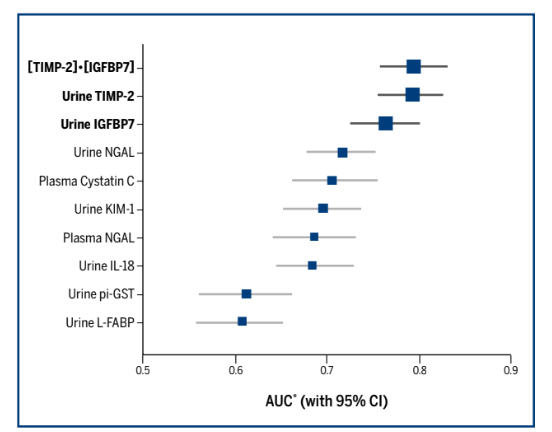
Existen moléculas que se pueden medir tanto en orina como en sangre que ayudan a identificar de forma predictiva la aparición de lesión renal aguda horas antes del desarrollo de esta patología. Desde la Cistatina C hasta el Ngal, IL 28 y moléculas como el KIM-3, todas ellas valiosas alternativas de diagnosticar daños en el panel celular del nefrón. Sin embargo, existen estudios que muestran que las moléculas en muestras de orina como el inhibidor tisular de metaloproteinasa 2 (TIMP-2) y la proteína ligadora del factor de crecimiento insulínico 7 (IGFBP7) presentan un desempeño mucho mayor a las anteriores con estudios estadísticos comparativos que revelan áreas bajo la curva (AUCs) para identificar pacientes en estadios 2 o 3 de la clasificación KDIGO en el estudio Sapphire(7).
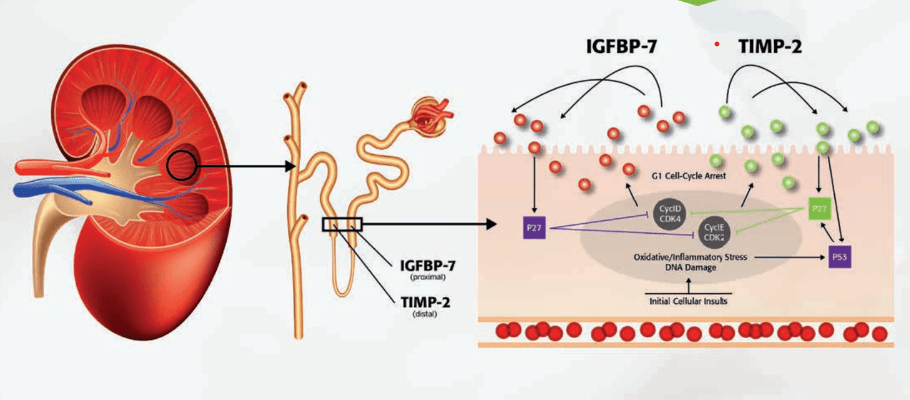
Estas dos moléculas (TIMP-2 y IGFBP7) están ganando fuerza en el medio comercial y son una excelente oportunidad para mejorar las condiciones de supervisión de los pacientes que ingresan a cuidados intensivos. Estas son liberadas al sistema urinario cuando las células tubulares se encuentran en un ambiente de estrés oxidativo y posterior inflamación, son el resultado de un sistema de arresto del ciclo celular G1 para evitar la expansión de células afectadas. Lo interesante del sistema es que se puede identificar de forma temprana la posible falla renal al verse el incremento en orina de estas moléculas, esto puede ser inclusive horas antes de presentarse un diagnóstico sintomático por aumento de creatinina o retención del volumen urinario (7).
Estos desarrollos prometen potenciar diversos aspectos de los sistemas de salud, porque disminuyen las probabilidades de empeorar las condiciones clínicas de los pacientes que ingresan a las UCIs, adicionalmente, reducen la estancia hospitalaria de los mismos, y en consecuencia una se logrará un menor gasto en pacientes de alto costo del sistema. Y solo estoy hablando de algunos de los beneficios de su implementación. Un programa de predicción de la enfermedad en estas instancias hospitalarias son una alternativa viable de sostenibilidad de mantenimiento de sistemas de salud preventivos.
La situación actual no es cercana a esta solución, existen muchos impedimentos para hacer efectivo la ejecución de este tipo de desarrollos, el principal a considerar es la imposibilidad de usar estas herramientas de forma proactiva, de momento no están incluidas en un plan de salud básico y debe ser autorizado bajo extensos protocolos administrativos. Por otro lado, la baja diseminación de este conocimiento en el ámbito hospitalario, quedando en manos del personal especializado del cuidado renal, en su alcance por medio de actualizaciones académicas y de este modo adquirir e impulsar estas tecnologías en sus respectivos centros de atención. Y por último y quizás no menos importante, la falta de programas de cuidado o protección renal en las instituciones de salud. Los programas de cuidado renal no deben quedar solo en manos de los especialistas, debería ser un sistema integral que incluya personal de múltiples disciplinas encaminado en mantener vigilar la función renal de sus pacientes y evitar el daño del mismo; creando un ecosistema que disemine el conocimiento para la prevención de la enfermedad en el ambiente hospitalario, prestando atención al ingreso de medicamentos nefrotóxicos, alimentación y perfusión adecuada de los riñones, estilos de vida saludables y todo lo relacionado con la prevención de estas patologías.
Al revisar documentación en la red encontramos muy poca información relacionada al desarrollo de programas de cuidado renal en nuestro país, inclusive en otros países es difícil encontrar programas relacionados con la causa. Existe un documento en Colombia (8) que pretende desarrollar una estrategia de prevención de la enfermedad renal crónica en Colombia sin embargo este documento es solo de forma orientativa, no establece lineamientos claros para abordar la enfermedad especialmente en este escenario de la insuficiencia renal aguda. Escasea información de programas de protección renal en instituciones prestadoras de servicio de salud. Existe evidencia de iniciativas de instituciones privadas de la implementación de programas de protección renal(9), pero son programas que no demuestran el uso de herramientas novedosas y potentes a nivel predictivo como es el uso de las moléculas TIMP-2 y IGFBP7.
Este capítulo hace una invitación especial al profesional de laboratorio a relacionarse con los nefrólogos de sus institución para hablar sobre el tema, en un marco coordinado por los directores médicos de los laboratorios y grupos interdisciplinarios de la institución y proveedores del producto para aumentar las probabilidades de desarrollar programas de cuidado renal, y mejorar los protocolos y estándares de manejo y cuidado del paciente con alto riesgo de desarrollar insuficiencia renal aguda.
Nota aclaratoria: No soy especialista del área de nefrología, solo expreso mi opinión en base a una investigación superficial sobre el tema, que pretende divulgar estas innovaciones en el área de la medicina predictiva. Mi opinión se basa en mi experiencia como profesional de laboratorio y no compromete ningún conflicto de interés. En próximas profundizaciones del tema se espera contar con la participación de un especialista del área.
NOTAS:
- The top 10 causes of death (who.int)
- Singbartl K, Kellum JA. AKI in the ICU: definition, epidemiology, risk stratification, and outcomes. Kidney Int. 2012 May;81(9):819-25. doi: 10.1038/ki.2011.339. Epub 2011 Oct 5. PMID: 21975865.
- Brivet FG, Kleinknecht DJ, Loirat P, Landais PJ. Acute renal failure in intensive care units–causes, outcome, and prognostic factors of hospital mortality; a prospective, multicenter study. French Study Group on Acute Renal Failure. Crit Care Med. 1996 Feb;24(2):192-8. doi: 10.1097/00003246-199602000-00003. PMID: 8605788.
- Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120(4):c179-84. doi: 10.1159/000339789. Epub 2012 Aug 7. PMID: 22890468.
- Waikar SS, Bonventre JV. Creatinine kinetics and the definition of acute kidney injury. J Am Soc Nephrol. 2009 Mar;20(3):672-9. doi: 10.1681/ASN.2008070669. Epub 2009 Feb 25. PMID: 19244578; PMCID: PMC2653692.
- Meersch M, Volmering S, Zarbock A. Prevention of acute kidney injury. Best Pract Res Clin Anaesthesiol. 2017 Sep;31(3):361-370. doi: 10.1016/j.bpa.2017.08.002. Epub 2017 Aug 18. PMID: 29248143.
- Kashani K, Al-Khafaji A, Ardiles T, Artigas A, Discovery and validation of cell cycle arrest biomarkers in human acute kidney injury. Crit Care. 2013 Feb 6;17(1):R25. doi: 10.1186/cc12503.
- https://www.google.com/url?sa=t&source=web&rct=j&opi=89978449&url=https://www.minsalud.gov.co/sites/rid/Lists/BibliotecaDigital/RIDE/INEC/CAC/programas_ERC.pdf&ved=2ahUKEwiV8JS-4cKFAxW1goQIHQ08B1IQFnoECCAQAQ&sqi=2&usg=AOvVaw3XvkmP8JkPQPLE0UsfSDtd
- González-Sánchez DA, Ayala Ramírez D, Aguirre D, Rodelo Ceballos J, Ustariz JM. Resultados clínicos de un programa de protección renal en pacientes con enfermedad renal crónica estadio 5 en Medellín, Colombia. Informe preliminar. Rev. Colomb. Nefrol. 2016; 3(2): 99-106.

Deja un comentario